«Белками теплового шока» (сокр. БТШ или HSP от англ. Heat shock proteins) называются особые соединения, которые клетки живых организмов продуцируют при резком повышении температуры или в результате других стрессовых нагрузок. Первые HSP впервые были обнаружены учеными еще в середине прошлого века. С тех пор роль белков теплового шока в организме растений, животных и человека активно изучалась.
Вначале считалось, что они выполняют исключительно защитную роль, предупреждая возникновение необратимых нарушений. Однако со временем выяснилось, что эти соединения могут принимать активное участие в регенерации поврежденных структур клетки, а также в работе иммунной системы.
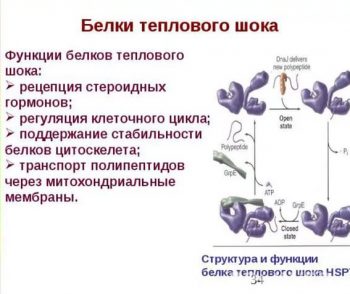
Белки теплового шока активно участвуют в клеточном метаболизме
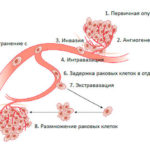
В том числе, была выдвинута гипотеза, что HSP участвуют в связывании белковых фрагментов, появляющихся при разрушении клеток злокачественных опухолей. При этом образуются конгломераты, распознаваемые противораковым иммунитетом в качестве «агрессора», т.е. происходит так называемая «презентация антигена». Другими словами, иммунная система человека получает возможность «видеть рак», который в обычных условиях может достаточно успешно от нее маскироваться. В результате запускается естественный процесс уничтожения опухоли.
Подтверждение этой теории, а также доскональное изучение структуры белка теплового шока и его действия в опухолевых тканях на молекулярном уровне, стало возможным только после того, как это уникальное вещество попало на международную космическую станцию. Отправили его в космос российские специалисты НИИ Особо Чистых Биопрепаратов ФМБА, синтезировавшие БТШ с помощью эксклюзивных технологий генной инженерии.

Директор НИИ ОЧБ Андрей Симбирцев и его сотрудники рассказывают о своих разработках участникам конференции
Благодаря невесомости, из исходного материала, «упакованного» в тончайшие молекулярные трубочки, выросли идеально ровные кристаллы белка, пригодные для рентгеноструктурного анализа. Космический этап позволил успешно решить главную проблему, стоявшую перед учеными: в условиях земного притяжения белки росли неравномерно, и получить кристаллы с правильной геометрией на Земле было невозможно. Анализ выращенных в космосе кристаллических белков был проведен российскими и японскими учеными на современном сверхмощном оборудовании.

Исследовать структуру синтезированного БТШ позволило выращивание кристаллов белка в лаборатории МКС
Полученные данные легли в основу создания уникального препарата, действие которого опробовали сначала в пробирках на клеточных культурах, а потом – на лабораторных животных. Лекарством на основе синтезированного БТШ были пролечены мыши с саркомой и меланомой, включая животных с четвертой (терминальной) стадией заболеваний.
Результаты оказались более чем впечатляющими:
- абсолютное большинство мышей полностью выздоровело;
- не было зарегистрировано ни одного побочного эффекта.
Как российские ученые получают белок теплового шока
HSP продуцируется клетками бактерий, в которые внедрен выделенный из клеток человека и клонированный ген. Этот ген отвечает за синтез белка теплового шока. В настоящее время его изготовление по данной технологии ведется на производственных участках НИИ ОЧБ.

Разработка и производство особо чистых биопрепаратов проводятся в условиях полной стерильности
Как «работает» лекарство, и какие виды рака можно будет лечить с его помощью
Применение биопрепарата направлено на повышение концентрации БТШ в опухолевых тканях онкобольных до значений, вызывающих терапевтический эффект. Такая потребность существует потому, что «показывающий рак иммунитету» белок теплового шока в организме человека:
- вырабатывается в очень небольших количествах;
- не может быть «собран» в здоровых клетках и «перенесен» в атипичные клетки раковой опухоли.
Разработчики утверждают, что разработанный ими метод универсален так же, как универсален сам белок, продуцируемый всеми тканями нашего организма. Поэтому если при дальнейших испытаниях лечебное действие лекарства подтвердится, а побочные не будут выявлены, его можно будет применять для терапии абсолютно всех форм рака.
Другие достоинства российской разработки:
- Лечение эффективно на терминальных стадиях, т.е. именно тогда, когда справится с опухолью каким-либо другим способом чрезвычайно сложно, очень часто – невозможно.
- Ученые рассматривают возможность целенаправленного действия препарата. До настоящего времени лекарство вводилось лабораторным животным внутривенно и распространялось с кровью по всему организму. На этапе клинических испытаний специалисты планируют параллельно с внутривенным введением опробовать методику адресной доставки белка теплового шока в клетки опухоли, рассчитывая еще более увеличить эффективность лечения и снизить риск побочных эффектов. Эта возможность принципиально отличает российскую технологию от метода «клеточной терапии CAR-T», официальное внедрение которого в клиническую практику ожидается уже летом 2017 года.
Деньги на заключительный этап доклинических исследований нового средства (порядка 100 млн. рублей) уже найдены. Остается найти спонсора, который разделит с государством финансирование клинических испытаний. Пока приоритеты отдаются российскому бизнесу. Если же российских спонсоров найти не удастся, будут рассматриваться варианты партнерства с японскими предпринимателями или бизнес-структурами из других стран. На завершение процесса испытаний может понадобиться еще 3-4 года. При их положительном исходе онкологи смогут получить высокоэффективный инструмент в борьбе с раком.
Что может сдерживать инвесторов и снижать уровень оптимизма при прогнозах
Вложения в любые клинические испытания несут достаточно большие риски для бизнеса. Ведь даже при современном развитии науки нельзя со стопроцентной вероятностью предположить, как поведет себя новое лекарство, насколько эффективным и безопасным оно окажется не в пробирке и в организме лабораторной мыши, а на практике. Тем не менее, поиски инвестиций – всего лишь вопрос времени.
Насколько действенным будет новый метод, также покажет время. Например, нельзя исключить, что при ослабленном естественном иммунитете его возможностей для борьбы с опухолью может просто не хватить.
И, разумеется, только по истечении нескольких лет можно будет понять:
- смогут ли раковые клетки мутировать в поисках защиты от «ударных доз» БТШ;
- не вызовет ли действие препарата нежелательных последствий в отдаленном периоде.